アレルギー疾患・自己免疫疾患とエピゲノム
アレルギー疾患・自己免疫疾患とエピゲノム
日本人の三人に一人がかかる花粉症やアトピー性皮膚炎などのアレルギー疾患、女性に多い関節リウマチや全身性エリテマトーデス(SLE)などの自己免疫疾患。これらの病気は、「免疫」の異常によって起こる病気です。

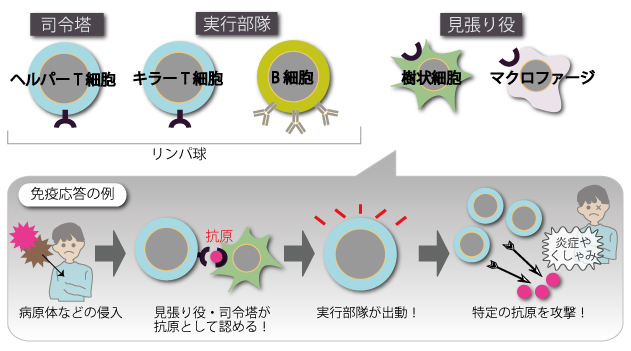
免疫は、外から侵入してくる病原体や体内でがん化した細胞を、免疫担当細胞のはたらき(図1)で攻撃して取り除き、健康を保ってくれる大切なしくみです。感染症から身を守る、同じ病気に二度かからない、ワクチン接種に効果が出るのも、免疫のおかげです。免疫担当細胞が攻撃する相手を「抗原」といいますが、免疫に異常がある患者さんでは、本来なら攻撃する相手ではない花粉や自分自身の身体の一部分が「抗原」となってしまっています。
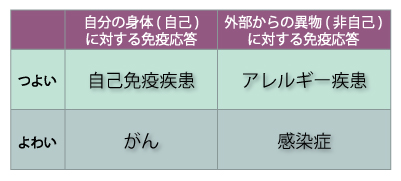
現在、アレルギー疾患や自己免疫疾患の治療では、免疫担当細胞のはたらきを一時的に抑える薬剤がつかわれます(免疫抑制剤、ステロイド、抗炎症剤など)。しかしこれらの薬剤は、さまざまな抗原に対する免疫応答を一度に抑えてしまうため、免疫系のバランスが変化し、感染症などのほかの病気にかかりやすくなる場合もあります(図2)。そこで望まれるのが、病気の原因となっている免疫応答だけをピンポイントで抑えて治療することのできる、新しい治療方法の開発です。
(図1)免疫担当細胞のはたらき
(図2)免疫応答のバランスと病気
 免疫の司令塔「ヘルパーT細胞」の分化とエピゲノム
免疫の司令塔「ヘルパーT細胞」の分化とエピゲノム
自己免疫疾患、アレルギー疾患の患者さんのリンパ球では、多くの場合、「ヘルパーT細胞」に何らかの異常がおきています。ヘルパーT細胞は、ほかの免疫担当細胞に指令を与え、抗体の産出や殺菌作用などを作動させる、免疫の司令塔です。何百万もの異なる種類の抗原を、個々のヘルパーT細胞が1種類ずつ分担して記憶でき、あらゆる免疫応答に備えています。
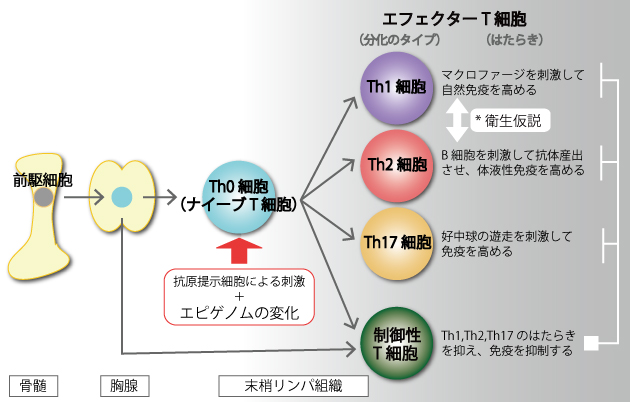
ヘルパーT細胞は、そのもととなる細胞(前駆細胞)が骨髄で誕生した後、心臓の上にある胸腺に移動して、「ナイーブT細胞(Th0細胞)」という役割の決まらない状態のT細胞として生まれます。胸腺を出たナイーブT細胞は身体の隅々の末梢のリンパ組織を循環しており、抗原の刺激を受けると、抗原の種類や環境に応じて役割の決まったエフェクターT細胞(Th1細胞、Th2細胞、Th17細胞、制御性T細胞)へと分化します(図3)。身体中をまわっているナイーブT細胞が、いつ、どこで、どのタイプのエフェクターT細胞に分化するかは、とても重要です。たとえば、Th1細胞やTh17細胞というエフェクターT細胞がつくられすぎると、自己組織への攻撃が過剰になり関節リウマチや全身性エリテマトーデス(SLE)などの自己免疫疾患が起こります。また、Th2細胞がつくられすぎると、外部からの異物に対する攻撃が過剰になりアレルギー疾患が起こりやすくなることが分かっています。
(図3)ヘルパーT細胞の分化とはたらき
そして、このようなT細胞の分化の運命を決定づけるのがエピゲノムなのです。DNAのメチル化やヒストンのアセチル化といったゲノムのエピジェネティックな変化は、さまざまな遺伝子のスイッチのオン・オフを切り替えることで、T細胞のはたらきを変化させます。またエピゲノムは、それぞれのT細胞の分化が後戻りしたり、別のタイプのThにならないように固定する役割もあります。
T細胞のエピゲノムと疾患との関連を解析した研究では、よく知られている例として、SLE患者のT細胞を解析したものがあります。SLE患者では、健常な人と比べて、T細胞の遺伝子の脱メチル化が広範囲で起きていることが報告されています。また動物実験では、T細胞を薬剤処理で脱メチル化すると自己免疫疾患が起こるという報告もされています。またタバコや環境汚染物質の多くが遺伝子のエピジェネティックな修飾を誘導することが知られており、アレルギー疾患とエピゲノムについても研究が進められています。
【図3の補足】
*衛生仮説:先進国でアレルギー性疾患が増加した理由としてStrachanが提唱した「乳児期までの不衛生な環境がアレルギーの発症を低下させる」という理論。衛生的な環境ではTh1細胞の成熟が起こらずTh2細胞が優位になるため、アレルギー疾患が起きやすいと考える
 T細胞のエピゲノム状態を操作して治療する
T細胞のエピゲノム状態を操作して治療する
T細胞のエピゲノムと疾患との関連の解析は、次世代シークエンサーの登場などにより、ここ数年で急速に進んでいます。日本では、大阪大学の坂口志文氏や千葉大学の中山俊憲氏らによって、T細胞にエピジェネティックな変化をもたらす遺伝子や蛋白質の特定がなされてきました。また、T 細胞と同様に重要な免疫担当細胞であるマクロファージについては、大阪大学の審良静男氏らのグループがエピゲノムの関連を精力的に研究しています。そして、こうして得られた情報を利用し、免疫担当細胞のエピゲノムを人為的に操作して病気を治療しようという新しいアプローチも出始めています。
とくに制御性T細胞のはたらきに着目し、自己免疫疾患・アレルギー疾患の治療法の開発をおこなっているのは、慶応義塾大学の吉村昭彦氏です。吉村氏はこれまでの研究で、ナイーブT細胞から制御性T細胞が分化したり維持されるためには、Foxp3という遺伝子のプロモーター領域はじめ、Foxp3遺伝子内の特定のDNA配列の脱メチル化が必須であることを確かめています。
吉村氏の研究計画(図4)では、患者さんの体内で異常な免疫応答を起こしているエフェクターT細胞を取り出し、エピゲノムを操作してナイーブT細胞にいったん戻した上で、制御性T細胞へと再び分化させます。この方法でつくった制御性T細胞は、病気の原因となっていたエフェクターT細胞に由来しているので、問題のある抗原に対する免疫応答だけを抑えられると考えられます。つまり、機能を増強した制御性T細胞を患者さんに移植して、“病気の原因となっている免疫応答だけをピンポイントで抑えて治療する”のです。移植された制御性T細胞は、患者さんの体内で抗原を記憶した状態で留まるので、治療の効果は長期的に続くと考えられます。
細胞の中の遺伝子についたエピジェネティックな目印を、人間の手で自由自在に操作するのは、簡単なことではありません。実際に血液のがんの治療でつかわれている薬剤は、広範囲の遺伝子にくっついたメチル化・アセチル化の目印を大雑把に外すもので、特異性は高くありません。吉村氏も現在は、ねらったDNA配列のメチル基だけを特異的に外す手法の開発を進めているところです。
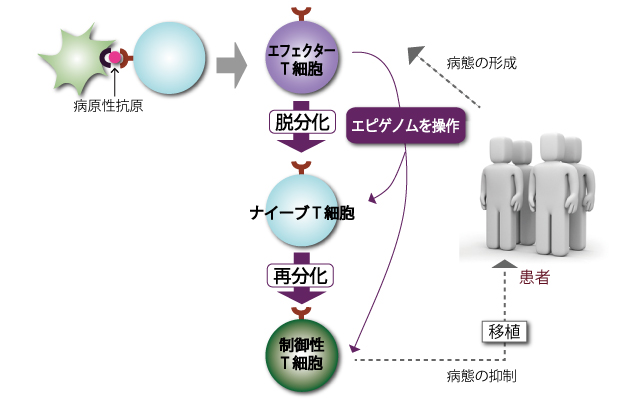
(図4)T細胞のエピゲノムを操作する治療モデル
 研究は始まったばかり
研究は始まったばかり
免疫の疾患とエピゲノムの研究は、がんとエピゲノムの研究と比較すると日が浅く、患者さんの治療で実用化されたものはまだありません。エピジェネティックな目印を外す機能をもつ既存の薬剤を自己免疫疾患のモデル動物の治療に利用するといった、基礎的な研究も始まったばかりです。将来、エピゲノム解析により免疫担当細胞のしくみがより明らかになり、ねらった遺伝子のエピジェネティックな目印だけを外す安全な手法が開発されれば、免疫の疾患だけでなく、さまざまな病気の治療に応用できると期待できます。
取材協力:吉村昭彦(慶応義塾大学医学部・教授)